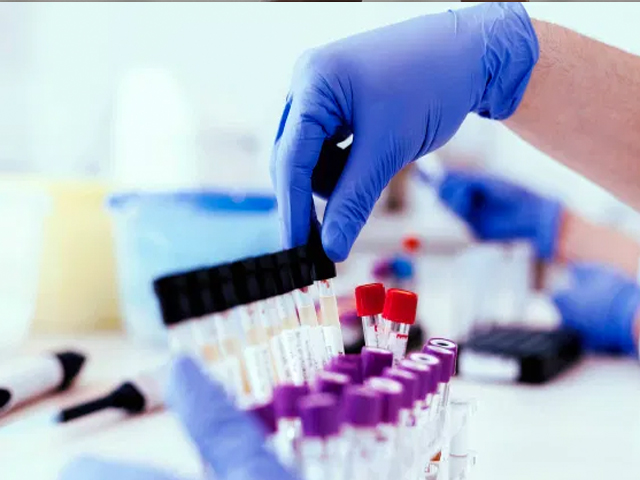
La Food and Drug Administration (FDA) de Estados Unidos, el organismo regulatorio que autoriza los medicamentos que se han de vender en el mercado aprobó más drogas en la última década que en las décadas del 1990 y del 2000. El cálculo lo hacen investigadores del Brigham and Women’s Hospital y de la Universidad de Harvard. Paralelamente el tiempo que se toma el organismo para revisar y aprobar pedidos de compañías farmacéuticas se ha reducido. Cuando antes llevaba tres años revisar todos los estudios y los resultados de las pruebas clínicas, en 2018 ese plazo se redujo a un año.
Esto, en parte, se debe a una decisión. Desde comienzos de los 80, el periodo cuando los investigadores comenzaron su estudio, el Congreso nacional aprobó una cantidad de leyes destinadas a acelerar el proceso de aprobación para casos específicos, como enfermedades raras u otras condiciones que no tuvieran opciones de tratamiento. Una de esas leyes, Prescription Drug User Fee Act, estuvo inspirada principalmente por el activismo que surgió después de la crisis del SIDA. Fue aprobada en 1992 y permitió a las compañías farmacéuticas dar dinero a la FDA para acelerar el proceso de revisión contratando más personal.
La sociedad se beneficia con un proceso de revisión que pone remedios salvadores lo antes posible en el mercado, especialmente para enfermedades como el Alzheimer y otras que son graves y deben esperar años para novedades.
Sin embargo, ahora la preocupación es que el proceso se haya acelerado demasiado y no ponga la debida atención en posibles efectos secundarios. En 2004, por ejemplo, la compañía Merck tuvo que retirar su analgésico Vioxx del mercado cuando algunos pacientes que lo tomaban desarrollaron problemas cardiovasculares después de tomarlo durante periodos prolongados.
“Es posible que se haya creado una cultura en la FDA donde el cliente principal no es más el paciente sino la industria”, dice un estudioso de la industria en la Harvard Medical School”.
El primer año luego de que la ley entrara en vigencia, las compañías farmacéuticas daban US$ 29 millones a la FDA; en 2018, el último año que el grupo de investigación tomó en cuenta, eran US$ 908 millones.
“Lo que vemos es un proceso regulatorio que con el tiempo se ha convertido en una jungla espesa de programas especiales, criterios de revisión flexibles y generosos incentivos”, dice Joshua Sharfstein, experto en salud pública de la Johns Hopkin’s University y ex miembro de la FDA.
Aunque el tiempo de revisión de la droga se redujo con los años, no ocurrió lo mismo con el tiempo que una compañía farmacéutica necesita para desarrollar un medicamento nuevo. Desde 1986 hasta 2017, todavía necesitaban un promedio de nueve años para llevar una droga a los análisis clínicos y al proceso de aprobación. Eso les cuesta un promedio de US$ 2.800 millones.