Skyhawk Therapeutics, Inc. comunicó el 29 de enero de 2026, en Boston, resultados provisionales a nueve meses de su ensayo clínico de fase 1 de SKY-0515, un tratamiento en investigación para la enfermedad de Huntington. El análisis intermedio se concentró en pacientes incluidos en la parte C del estudio y combinó mediciones clínicas con biomarcadores en sangre.
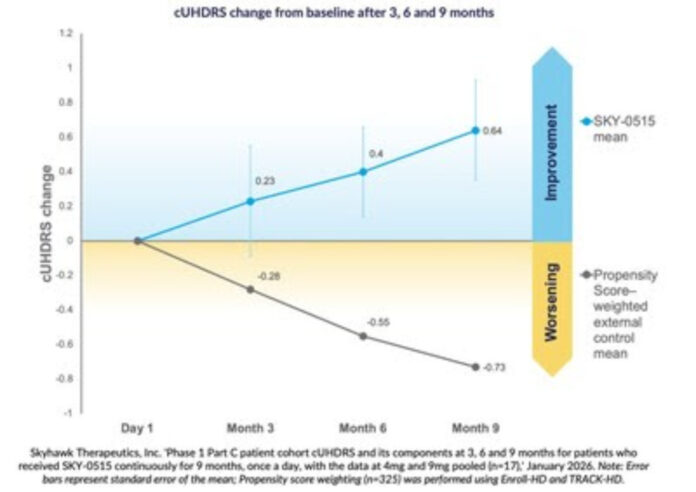
En la cohorte de la parte C, los pacientes mostraron una mejora promedio desde el inicio en la escala compuesta unificada de valoración de la enfermedad de Huntington (cUHDRS, por sus siglas en inglés). A los nueve meses, el análisis agrupado reflejó una mejora de +0,64 puntos, frente al empeoramiento esperado de -0,73 puntos durante el mismo período en pacientes sintomáticos, estimado mediante ponderación de la puntuación de propensión con datos de Enroll-HD y TRACK-HD.
En biomarcadores, SKY-0515 registró reducciones dependientes de la dosis de la proteína mHTT en sangre del 62% con la dosis de 9 mg. También se observó una reducción dependiente de la dosis del ARNm de PMS1 del 26%. El PMS1 fue descripto como un factor clave de la ampliación de la repetición citosina-adenina-guanina (CAG) somática y de la patología asociada a la enfermedad.
En materia de farmacología, el compuesto demostró exposición al sistema nervioso central y fue reportado como generalmente seguro y bien tolerado. En la parte C, el diseño incluyó un esquema doble ciego, controlado con placebo, con dos niveles de dosis durante 84 días y una extensión de 12 meses de tratamiento activo.
Ed Wild, profesor de neurología en el University College de Londres, señaló: “Me siento muy alentado por estos datos de seguridad y eficacia temprana del ensayo de fase 1 parte C de SKY-0515 en pacientes”.
Sergey Paushkin, jefe de investigación y desarrollo (I + D) de Skyhawk Therapeutics, afirmó: “Nuestro objetivo para el estudio de fase 1 fue establecer la seguridad y la actividad de los biomarcadores”.
En paralelo, Skyhawk amplió a todo el mundo su ensayo FALCON-HD de fase 2/3 de SKY-0515, que había abierto en 12 sitios en Australia y Nueva Zelanda. La compañía ya administró una dosis a más de 90 pacientes. FALCON-HD es un estudio aleatorizado, doble ciego, controlado con placebo y de rango de dosis, con 120 participantes en esos 12 sitios y 400 participantes adicionales en más de 40 sitios globales, con un período de tratamiento de al menos 12 meses.